Bagaimana
menyebutkan nama senyawa berdasrkan komponen penyusunnya? Apakah semua
senyawa yang telah ditemukan memiliki nama khusus?Dulu,senyawa dinamakan
sesuai asal ditemukannya,misalnya,asam etanoat diberi nama asam asetat
yang berasal dari cuka. Semakin banyaknya senyawa baru yang
ditemukan,diperlukan suatu aturan penamaan yang berlaku internasional.
Lembaga yang berwenang untuk merumuskan tata nama senyawa secara
international adalah
The International Union of Pure and Applied Chemistry (IUPAC).
1. Penamaan Senyawa Biner Ionik
Untuk penamaan senyawa biner ionik yang dibentuk dari satu unsur logam
dan satu unsur bukan logam, mula-mula dituliskan nama logam tanpa
modifikasi dan diikuti dengan penamaan unsur bukan logam melalui
pemberian akhiran ‘ida’.
KCl : Kalium klorida
MgF2 : Magnesium fluorida
KO : Kalium oksida
Senyawa ion walaupun terdiri dari ion positif dan ion negatif tetapi
secara keseluruhan bermuatan nol. Satuan rumus harus mengandung ion
positif dan ion negatif sedemikian rupa sehingga jumlah muatan bersihnya
: nol. Unsur-unsur tertentu dapat mempunyai lebih dari satu bentuk ion.
Untuk menyatakan perbedaan rumus dan nama-nama senyawa, dalam hal ini
kita tentukan bilangan oksidasi unsur-unsur tersebut. Ada dua sistem
penulisan yang umum dipergunakan :
1) Penamaan dengan penulisan bilangan oksidasi memakai angka romawi (SISTEM STOCK).
2) Penamaan dengan sistem akhiran ‘O’ untuk kation dengan bilangan
oksidasi yang lebih rendah, akhiran ‘i’ untuk kation dengan bilangan
oksidasi yang lebih tinggi.
– Contoh :
CrCl2 Kromium (II) klorida Kromo klorida
CrCl3 Kromium (III) klorida Kromi klorida
Pb2O Plumbum (I) oksida Plumbo oksida
PbO Plumbum (U) oksida Plumbi oksida
2. Penamaan Senyawa Biner Kovalen
Penamaan senyawa biner kovalen yang terdiri dari unsur non-logam dengan
unsur non-logam, mula-mula dituliskan unsur dengan bilangan oksidasi
positif. Misalnya kita tuliskan HCl bukannya CIH. Penamaan dilakukan
dengan dasar pemberian awal yang menyatakan jumlah relatif tiap jenis
atom dalam sebuah molekul pemberian awalan dengan mempergunakan :
mono = 1 hepta = 7
di (bis) = 2 okta = 8
tri (tris) = 3 nona = 9
tetra (tetrakis) = 4 deka = 10
penta (pentakis) = 5 undeka = 11
heksa (heksakis) = 6 dodeka = 12
Awalan yang berada dalam kurung kini jarang dipergunakan dan lebih
banyak dipakai dalam penamaan senyawa kompleks. Jadi untuk dua oksida
utama belerang dapat kita tulis :
S02 : belerang dioksida atau berdasarkan sistem stock : belerang (IV) oksida
SO : belerang trioksida atau berdasarkan sistem stock : belerang (VI) oksida
Sistem awalan dapat menunjukkan hubungan antara nama dan rumus dengan
tepat, sedangkan sistem stock ternyata tak selalu dapat menampakkan
hubungan nama dan rumus.
– Contoh :
BCl3 : Boron triklorida/ Boron (III) klorida
CF4 : Karbon tetrafluorida/ Karbon (IV) fluorida
CO : Karbon monooksida/ Karbon (II) oksida
N2O3 : Dinitrogen trioksida/ Nitrogen (III) oksida
SF6 : Sulfor heksafluorida/ Sulfor (VI) fluorida
3. Penamaan Asam-asam Biner
Ada segolongan senyawa biner kovalen yang dalam keadaan tertentu dapat
melepaskan ion-ion hidrogen (H+) sehingga senyawa tersebut dikenal
sebagai suatu ‘asam’. Asam-asam biner penting sangat terbatas jumlahnya.
Penamaannya berdasarkan gabungan dari awalan ‘hidro’ dengan nama bukan
logam yang diberi akhiran ‘at’.
– Contoh:
HF asam hidrofluorat (asam fluorida)
HBr asam hidrobromat (asam bromat)
H2S asam hidrosulforat (asam sulfida)
4. PENAMAAN SENYAWA POLIATONIK
Senyawa poliatomik merupakan senyawa
yang mengandung ion poliatomik. Ion poliatomik terdiri dari dua atom
atau lebih yang terikat bersama. Anion poliatomik umumnya lebih banyak
dibandingkan dengan jenis kation pliatomik. Unsur yang banyak terdapat
pada anion pliatomik adalah oksigen. Oksigen yang terikat dengan atom
bukan logam lainnyadisebut oksoanion. Sejumlah unsur tertentu membentuk
deret oksoanion yang mengandung jumlah atom oksigen yang berbeda-beda.
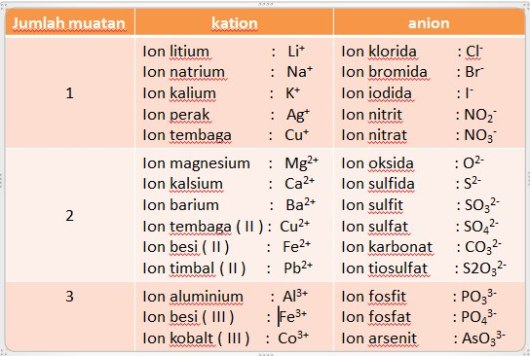
Tabel kation dan anion
|
No
|
Rumus
|
Nama Ion
|
No
|
Rumus
|
Nama Ion
|
|
1
|
NH4+ |
Amonium |
19
|
AsO33- |
Arsenit |
|
2
|
O2- |
Oksida |
20
|
AsO43- |
Arsenat |
|
3
|
F- |
Florida |
21
|
SbO33- |
Antimonit |
|
4
|
Cl- |
Klorida |
22
|
SbO43- |
Antimonat |
|
5
|
Br- |
Bromida |
23
|
ClO- |
Hipoklorit |
|
6
|
I- |
Iodida |
24
|
ClO2- |
Klorit |
|
7
|
CN- |
Sianida |
25
|
ClO3- |
Klorat |
|
8
|
S2- |
Sulfida |
26
|
ClO4- |
Perklorat |
|
9
|
CO32- |
Karbonat |
27
|
MnO4- |
Permanganat |
|
10
|
SiO32- |
Silikat |
28
|
MnO42- |
Manganat |
|
11
|
C2O42- |
Oksalat |
29
|
CrO42- |
Kromat |
|
12
|
CH3COO/C2H3O2- |
Asetat |
30
|
Cr2O72- |
Dikromat |
|
13
|
SO32- |
Sulfit |
31
|
OH- |
Hidroksida |
|
14
|
SO42- |
Sulfat |
32
|
HSO3- |
Bisulfit |
|
15
|
NO2- |
Nitrit |
33
|
HPO42- |
Hidrogen Fosfat |
|
16
|
NO3- |
Nitrat |
34
|
H2PO4- |
Dihidrogen Fosfat |
|
17
|
PO33- |
Fosfit |
35
|
BO33- |
Borat |
|
18
|
PO43- |
Fosfat |
|
|
|
|
No
|
Rumus
|
Nama Ion
|
No
|
Rumus
|
Nama Ion
|
|
1
|
Na+ |
Natrium |
13
|
Pb2+ |
Plumbum/Timbal (II) |
|
2
|
K+ |
Kalium |
14
|
Pb4+ |
Plumbum/Timbal (IV) |
|
3
|
Mg2+ |
Magnesium |
15
|
Fe2+ |
Ferrum/Besi (II) |
|
4
|
Ca2+ |
Kalsium |
16
|
Fe3+ |
Ferrum/Besi (III) |
|
5
|
Sr2+ |
Stronsium |
17
|
Hg+ |
Hidrargium/Raksa (I) |
|
6
|
Ba2+ |
Barium |
18
|
Hg2+ |
Hidrargium/Raksa (II) |
|
7
|
Al3+ |
Alumunium |
19
|
Cu+ |
Cupper/Tembaga (I) |
|
8
|
Zn2+ |
Zink / Seng |
20
|
Cu2+ |
Cupper/Tembaga (II) |
|
9
|
Ni2+ |
Nikel |
21
|
Au+ |
Aurum/Emas (I) |
|
10
|
Ag2+ |
Argentum / Perak |
22
|
Au3+ |
Aurum/Emas (III) |
|
11
|
Sn2+ |
Stanum/Timah (II) |
23
|
Pt4+ |
Platina (IV) |
|
12
|
Sn4+ |
Stanum/Timah (IV) |
|
|
|
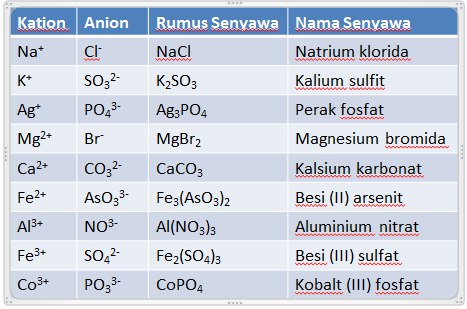
Penamaan senyawa poliatom bergantung pada muatan masing-masing ionnya. Contohnya :
CaCO3 : Kalsium Karbonat
BaSO4 : Barium Sulfat
1. Tata Nama Senyawa Biner yang Tersusun atas Unsur Logam dan Nonlogam
Suatu senyawa dapat tersusun atas dua atau lebih unsur kimia. Senyawa
yang tersusun atas dua unsur kimia disebut senyawa biner. Bagaimana cara
memberi nama senyawa biner yang dibentuk oleh satu unsur logam dan satu
unsur nonlogam? Berikut tata nama senyawa biner yang tersusun atas
unsur logam dan nonlogam.
a. Tulislah nama logam tanpa modifikasi dan diikuti dengan penulisan nama unsur nonlogam melalui pencantuman akhiran “ida”.
b. Jumlah unsur yang menyusun senyawa tidak berpengaruh terhadap penamaan senyawa.
Senyawa KCl (kalium klorida) terdiri atas
unsur kalium dan klor. Kalium bertindak sebagai kation sehingga namanya
tidak diubah. Klor bertindak sebagai anion sehingga ditambahkan akhiran
-ida yaitu klorida. Jadi, nama senyawa KCl adalah kalium klorida.
Dapatkah Anda memberi nama senyawa KBr, CaCl2, dan AgCl2? Agar Anda
lebih memahami hal ini, pelajarilah contoh soal berikut.
Berilah nama pada senyawa berikut:
a. NaBr c. AlCl3
b. MgCl2 d, Na2S
Jawab :
a. NaBr tersusun atas kation Na+ (atom natrium) dan anion Br- (atom
brom). Nama kation sama dengan nama atomnya dan nama anion sama dengan
nama atom diberi akhiran ida (bromida). Dengan demikian nama NaBr
menjadi natrium bromida.
b. MgCl2 = magnesium klorida
c. AlCl3 = aluminium klorida
d. Na2S = natrium sulfida
e. CaF2 = kalsium fluorida
Soal : Tuliskanlah rumus senyawa dari nama-nama senyawa berikut:
a. litium sulfida
b. magnesium oksida
c. barium iodida
d. aluminium hidrida
e. seng klorida
f. kalium iodida
2. Tata Nama Senyawa Biner yang Tersusun atas Nonlogam dan Nonlogam
Senyawa biner dari nonlogam dan nonlogam disebut dengan senyawa kovalen
biner. Cara penamaan senyawa kovalen biner adalah sama seperti senyawa
ion, yaitu diberi akhiran “ida”. Jika pasangan unsur hanya membentuk
satu jenis senyawa, angka indeks (jumlah atom) tidak perlu disebutkan.
Contoh:
HCl = hidrogen klorida
Beberapa pasang unsur dapat pula membentuk lebih dari satu senyawa
biner. Penamaan senyawa harus disebutkan jumlah atomnya dalam angka
latin dengan indeks dalam bahasa Yunani.
Indeks angka satu untuk unsur pertama umumnya tidak pernah disebutkan.
Contoh:
CO = karbon monoksida
CO2 = karbon dioksida
N2O3 = dinitrogen trioksida
N2O5 = dinitrogen pentoksida
HBr = hidrogen bromida
HF = hidrogen fluorida
CS2 = karbon disulfida
Untuk lebih jelasnya, perhatikanlah beberapa contoh penamaan senyawa berikut.
Berilah nama pada senyawa-senyawa berikut:
a. SO2 c. CCl4
b. SO3 d. N2O4
Jawab :
a. SO2 tersusun atas satu atom belerang dan dua atom oksigen sehingga
namanya menjadi belerang dioksida (indek angka satu unsur pertama tidak
disebutkan) Dengan menggunakan cara yang sama diperoleh:
b. SO3 = belerang trioksida
c. CCl4 = karbon tetraklorida
d. N2O4 = dinitrogen tetraoksida
Soal : Tuliskan rumus kimia dari nama-nama senyawa berikut:
a. boron triklorida
b. belerang heksafluorida
c. dinitrogen pentoksida
d. disulfur diklorida
3. Tata Nama Senyawa Poliatom
Senyawa poliatom dibentuk oleh lebih dari dua atom yang berbeda. Pada
umumnya senyawa ini dibentuk oleh ion-ion poliatomik. Ion-ion poliatomik
itu sendiri adalah ion-ion yang terdiri atas dua atom atau lebih yang
terikat bersama, umumnya dijumpai tersusun atas unsur-unsur nonlogam.
Beberapa catatan aturan :
a. Anion poliatomik umumnya lebih banyak dibandingkan kation poliatomik.
Suatu kation poliatomik yang umum dijumpai adalah NH4 +.
b. Hanya sedikit anion poliatomik yang memiliki nama dengan akhiran
“ida”. Hanya OH- (ion hidroksida) dan CN- (ion sianida). Sedangkan yang
lainnya lebih banyak berakhiran “it” dan “at” dan ada juga berawalan
“hipo” dan “per”.
c. Nama anion beroksigen diberi akhiran “at” (untuk atom oksigen lebih
banyak) dan “it” (untuk atom oksigen lebih sedikit). Contoh:
Na2SO4 = natrium sulfat
Na2SO3 = natrium sulfit
K3PO4 = kalium fosfat
K3PO3 = kalium fosfit
d. Nama senyawa ion poliatomik adalah gabungan nama kation, nama anion
dan angka indeks tidak disebutkan. Senyawa ion bersifat netral, jumlah
muatan positif sama dengan jumlah muatan negatif.
Contoh:
Senyawa ion poliatom dari K+ dengan OH- : KOH (kalium hidroksida)
Senyawa ion poliatom dari Mg2+ dengan NO3 – : Mg(NO3)2 (magnesium
nitrat) Senyawa ion poliatom dari Al3+ dengan SO4 2- : Al2(SO4)3
(aluminium sulfat)
Jika membentuk lebih dari dua anion, tata nama senyawanya sebagai berikut.
Ca2+ dengan ClO- : Ca(ClO)2 (kalsium hipoklorit)
Ca2+ dengan ClO2- : Ca(ClO2)2 (kalsium klorit)
Ca2+ dengan ClO3- : Ca(ClO3)2 (kalsium klorat)
Ca2+ dengan ClO4- : Ca(ClO4)2 (kalsium perklorat)
Tuliskanlah rumus senyawa ion poliatom dan beri nama dari gabungan ion berikut:
a. ion K+ dan ion CN-
b. ion NH4+ dan ion Cl-
c. ion Mg2+ dan ion OH-
d. ion Na+ dan ion CO32-
e. ion Ca2+ dan ion PO43-
Jawab :
Senyawa ion bersifat netral, sehingga:
a. 1 ion K+ dengan 1 ion CN- = KCN kalium sianida
b. 1 ion NH4 + dengan 1 ion Cl- = NH4Cl amonium klorida
c. 1 ion Mg2+ dengan 2 ion OH- = Mg(OH)2 magnesium hidroksida
d. 2 ion Na+ dengan 1 ion CO3 2- = Na2CO3 natrium karbonat
e. 3 ion Ca2+ dengan 2 ion PO4
3- = Ca3(PO4)2 kalsium fosfat
Soal : Tuliskanlah rumus senyawa ion dari nama-nama senyawa berikut:
a. seng nitrat
b. kalsium sulfat
c. magnesium fosfat
d. natrium oksalat
e. tembaga(II) nitrat
4. Tata Nama Asam
Asam adalah senyawa kovalen yang terdiri atas ion H+ (sebagai kation)
dan suatu anion. Penamaan asam didahului dengan kata asam yang diikuti
nama anion.
Contoh:
HBr = asam bromida
H2SO4 = asam sulfat
HNO3 = asam nitrat
Tentukanlah nama asam berikut:
a. HCl
b. HCN
c. H2S
d. H2CO3
e. H3PO4
f. CH3COOH
Jawab :
a. HCl = asam klorida
b. HCN = asam sianida
c. H2S = asam sulfida
d. H2CO3 = asam karbonat
e. H3PO4 = asam fosfat
f. CH3COOH = asam asetat
5. Tata Nama Basa
Pada umumnya basa adalah senyawa ion dari logam dengan ion OH-.
Penamaannya diawali dengan menyebutkan ion logam dan diikuti dengan
hidroksida.
Contoh:
KOH = kalium hidroksida
Mg(OH)2 = magnesium hidroksida
Fe(OH)2 = besi(II) hidroksida
Tentukan nama basa berikut:
a. NaOH
b. Ca(OH)2
c. Al(OH)3
d. Zn(OH)2
e. Ba(OH)2
Jawab :
a. NaOH = natrium hidroksida
b. Ca(OH)2 = kalsium hidroksida
c. Al(OH)3 = aluminium hidroksida
d. Zn(OH)2 = seng hidroksida
e. Ba(OH)2 = barium hidroksida
Soal Latihan :
1. Tuliskanlah lambang unsur atau rumus molekul materi berikut :
a. perak
b. emas
c. garam dapur
d. air
e. kalium permanganat
f. kalium tiosianat
g. asam dikromat
h. amonium hidroksida
2. Tuliskanlah nama-nama senyawa biner dan poliatomik berikut :
a. NaOH
b. AlCl3
c. BF3
d. Al2(SO4)3
e. KClO3
f. (NH4)2SO4